Углекислый газ молекулярная формула
Углекислый газ

Содержание
- Углекислый газ и его физические свойства
- Химические и биологические свойства углекислого газа
- Что мы узнали?
Бонус
- Тест по теме
Углекислый газ и его физические свойства
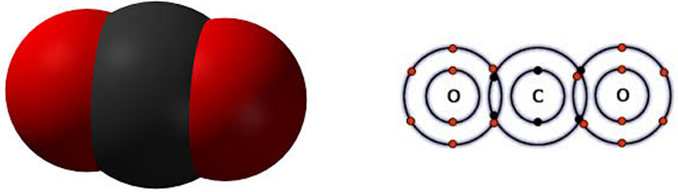
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.

Рис. 1. Молекула углекислого газа.
Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».

Рис. 2. Сухой снег – углекислый газ.
Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44.
n – число атомов или молекул.
Ar – относительная атомная масса химического элемента.
Mr – относительная молекулярная масса вещества.
Рассчитаем относительную молекулярную массу углекислого газа.
Химические и биологические свойства углекислого газа
Углекислый газ обладает кислотными свойствами, так как является кислотным оксидом, и при растворении в воде образует угольную кислоту:
Вступает в реакцию со щелочами, в результате чего образуются карбонаты и гидрокарбонаты. Этот газ не подвержен горению. В нем горят только некоторые активные металлы, например, магний.
При нагревании углекислый газ распадается на угарный газ и кислород:
Как и другие кислотные оксиды, данный газ легко вступает в реакцию с другими оксидами:
Углекислый газ входит в состав всех органических веществ. Круговорот этого газа в природе осуществляется с помощью продуцентов, консументов и редуцентов. В процессе жизнедеятельности человек вырабатывает примерно 1 кг углекислого газа в сутки. При вдохе мы получаем кислород, однако в этот момент в альвеолах образуется углекислый газ. В этот момент происходит обмен: кислород попадает в кровь, а углекислый газ выходит наружу.
Получение углекислого газа происходит при производстве алкоголя. Также этот газ является побочным продуктом при получении азота, кислорода и аргона. Применение углекислого газа необходимо в пищевой промышленности, где углекислый газ выступает в качестве консерванта, а также углекислый газ в виде жидкости содержится в огнетушителях.

Рис. 3. Огнетушитель.
Что мы узнали?
Углекислый газ – вещество, которое в нормальных условиях не имеет цвета и запаха. помимо своего обычного названия – углекислый газ, его также называют оксидом углерода или диоксидом углерода.
Формула углекислого газа
Химическая, структурная и электронная формулы углекислого газа
Химическая формула: СО2.
Структурная формула: O = C = O
Молярная масса: 44,01 г/моль.
Физические свойства углекислого газа
При стандартных условиях – газ без цвета и запаха, с кисловатым вкусом. При атмосферном давлении не существует в жидком состоянии, при сильном охлаждении кристаллизуется в виде «сухого льда» – белой снегообразной массы. Температура сублимации равна –78 °С. При нормальных условиях в одном объеме воды растворяется 0,9 объемов углекислого газа.
Химические свойства углекислого газа
Является кислотным оксидом.
- При растворении в воде образует угольную кислоту:
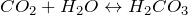
Взаимодействует с основными оксидами и основаниями, образуя карбонаты и гидрокарбонаты (соли угольной кислоты):
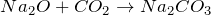
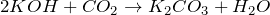
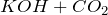 (избыток)
(избыток) 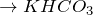
Не поддерживает горение, но при нагревании может окислять активные металлы:
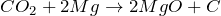
Качественная реакция – помутнение известковой воды (Ca(OH)2) за счет образования белого осадка карбоната кальция:
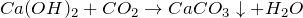
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
В промышленности углекислый газ получают термическим разложением карбонатов:
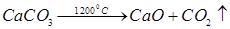
В лаборатории – действием сильных кислот на карбонаты или гидрокарбонаты:
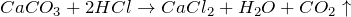
Примеры решения задач
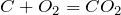
Рассчитаем количество вещества углерода по формуле:
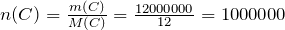 моль
моль
По уравнению реакции
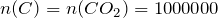 моль
моль
1 моль газа при нормальных условиях занимает объем 22,4л.
Рассчитаем теоретический объем углекислого газа:
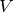 теор.
теор. 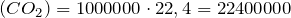 л
л 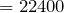 м
м 
Рассчитаем практический объем углекислого газа:
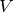 практ.
практ. 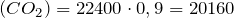 м
м 
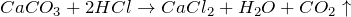
В процессе реакции образуется угольная кислота (H2CO3), которая сразу разлагается на воду (H2O) и углекислый газ (CO2).
Рассчитаем количество вещества углекислого газа по формуле:
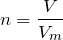
где Vm – молярный объем, т.е. объем, который занимает один моль газа при нормальных условиях. 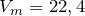 л/моль.
л/моль.
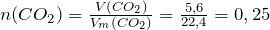 моль
моль
Для расчета количества вещества соляной кислоты составим пропорцию по уравнению реакции:
2 моль HCl приводят к образованию 1 моль CO2
x моль HCl приводят к образованию 0,25 моль CO2
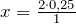 моль
моль
Молярная масса соляной кислоты равна 36,5 г/моль. Рассчитаем массу соляной кислоты:
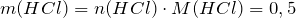 моль
моль 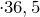 г/моль
г/моль 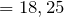 г
г
Выражение для массовой доли вещества в растворе:
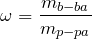
Рассчитаем массу раствора соляной кислоты по формуле:
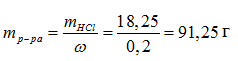
Если раствор HCl 20%, то массовая доля соляной кислоты в нем будет равна 0,20.
Рассчитаем объем раствора соляной кислоты по формуле:
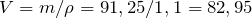 мл
мл
Углекислый газ и его физические свойства — объем, плотность, масса, формула

Углекислый газ представляет собой бесцветный газ, без запаха,который относится к неорганическим веществам. Другие названия вещества — диоксид углерода, двуокись углерода, углекислота, диоксид карбона, угольный ангидрид. Молекула углекислого газа состоит из атома углерода, соединенного двойной ковалентной связью с двумя атомами кислорода.

Химическая формула — CO2. Молярная масса углекислоты равна 44,01 г/моль. Расстояние от центра центрального атома углерода до каждого центра атома кислорода равно 116,3 пикометров (10 в -12 степени).

CO2 при низких температурах и нормальном давлении замерзает и кристаллизуется в белую массу, похожую на снег — «Сухой лед». При превышении температуры (-78.5 °C) начинается его испарение (кипение), минуя фазу жидкостного состояния.
В жидкостное состояние газ преобразуется при высоком давлении (73.8 атм.) и средних температурах (+31.1 °C). Это критическая точка углекислоты. Подъем температуры или давления после нее приводит к образованию сверхкритической жидкости (Отсутствует различие между жидкостной и газовой фазой). При снижении температуры до -56.6 °C и давления до 5.2 атм. он остается в жидкостной фазе. Это предельные значения, при изменении которых углекислота переходит в газообразную или твердую фазу (тройная точка состояний).

CO2 не ядовит, но при превышении концентрации в десятки раз, он оказывает удушающее воздействие на живые организмы и вызывает кисловатый вкус и запах (реакция CO2 со слюной и слизистыми образует угольную кислоту).
Двуокись углерода превышает по плотности кислород на 37 процентов и равна 1,96 кг/м3 при нормальных условиях среды (температура — 273 К, давление — 101 кПа). Этим физическим свойством объясняется потеря сознания у животных в «Собачьей пещере», расположенной рядом с городом Поццуоли, Италия. Диоксид углерода скапливался из трещин кратеров в нижних слоях пещеры, тем самым достигая больших концентраций. Туристов приводили туда обычно с собакой, которая в пещере с течением времени теряла сознание. Человек обычно не подвергался воздействию CO2, так как дышал воздухом с более высокого уровня.

Объем углекислого газа в окружающем нас воздухе, составляет 0,04% (406 ppm – 406 частиц на миллион).
Углекислый газ молекулярная формула

3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
1) с водой даёт непрочную угольную кислоту:
2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca ( OH )2 за счёт образования белого осадка – нерастворимой соли CaCO 3 :

Угольная кислота и её соли
Структурная формула – все связи ковалентные полярные:

Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор – лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
· Кислые соли – бикарбонаты, гидрокарбонаты Na HCO3 , Ca ( HCO 3 )2
В природе встречаются :





K 2 CO 3 (поташ, в золе растений)
Na 2 CO 3 – сода, кальцинированная сода
Na 2 CO 3 x 10 H 2 O – кристаллическая сода
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№ 1. Закончите уравнения осуществимых химических реакций:



