Взаимодействие ацетилена с водородом
Тема 3.4. Ацетиленовые углеводороды (алкины)
Алкины – это углеводороды, содержащие в своей структуре тройную связь. Общая формула ацетиленовых углеводородов СnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Номенклатура.По рациональной номенклатуре производные ацетилена рассматриваются как его замещенные, называются радикалы с прибавлением слова «ацетилен».
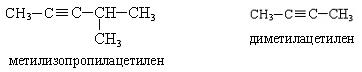
По систематической номенклатуре названия ацетиленовых углеводородов даются от соответствующих предельных углеводородов с заменой окончания на «-ин», нумерацию начинают с того конца, где ближе тройная связь:
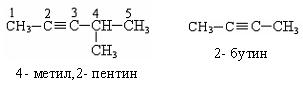
Способы получения.Существует несколько способов получения алкинов.
1. Электрокрекинг метана:
2СН4 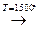 СН ≡ СН + 3Н2
СН ≡ СН + 3Н2
Реакцию проводят электродуговым способом, пропуская метан между электродами с временем контакта 0,1 – 0,01 секунды, чтобы ацетилен не разложился.
2. Синтез из углерода и водорода в вольтовой дуге:
2С + Н2 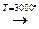 СН ≡ СН
СН ≡ СН
3. Окислительный крекинг метана:
4СН4 + 5О2 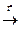 СН ≡ СН + СО + 7Н2О
СН ≡ СН + СО + 7Н2О
4. Синтез из карбида кальция (ацетиленида кальция):
Исходным веществом является СаСО3, разложением которого получается СаО, а затем карбид кальция:
б) СаО+ 3С → СаС2 + СО
5. Синтез из альдегидов:
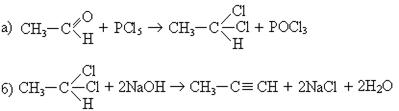
6. Синтез производных ацетилена через амид:
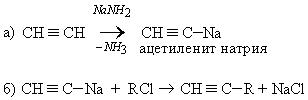
Химические свойства.Атомы углерода по тройной связивалкинах находятсяв состоянии sp-гибридизации и имеют две π-связи:
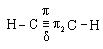
Типичными реакциями ацетиленовых углеводородов, к которым располагает электронная структура ацетилена, являются реакции электрофильного присоединения (АdЕ).
Другим направлением химически реакционной способности являются реакции нуклеофильного присоединения (АdN), возможность протекания которых объясняется большим вкладом s-орбитали в гибридное облако при sp-гибридизации, которое по форме приближается к сфере, а значит, электроны p-связи сильнее притягиваются ядром и не очень доступны для электрофильных частиц.
Кроме того, ацетиленовые углеводороды вступают в реакции замещения, окисления и полимеризации.
Реакции электрофильного присоединения (АdE).
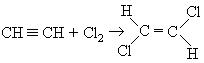
Реакция идет в транс-положение.
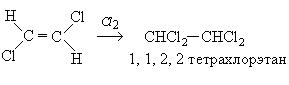
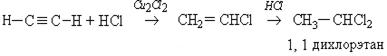
Гидрогалогенирование несимметричных производных ацетилена происходит в соответствии с правилом Морковникова:
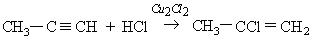
3. Гидрогенизация. В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов, а затем алканов:
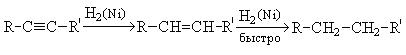
При использовании менее активного катализатора [Pd/CaCO3/Pb(CH3COO)2] гидрирование останавливается на стадии образования алкенов.
4. Гидратация (реакция Кучерова). Присоединение воды происходит в присутствии катализатора, соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид:
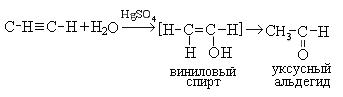
Процесс изомеризации находится в соответствии с правилом Эдьтекова, согласно которому структура гидроксила при двойной связи нестабильна и всегда изомеризуется в структуру, содержащую карбонильную группу. Этот переход называется еще кето-енольной таутометрией. При гидратации производных ацетилена образуются кетоны:
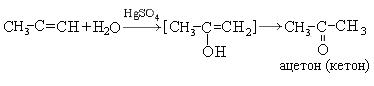
5. Реакция с карбоновыми кислотами:
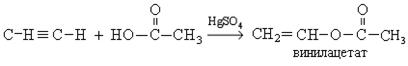
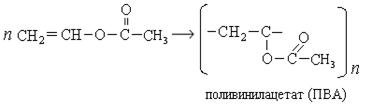
Поливинилацетат используется для изготовления водо-эмульсионных красок, клея, лака.
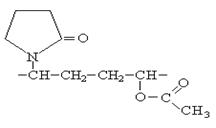
Сополимер винилацетата с винилпиролидоном является основным компонентом лака для волос.
Переэтерификация поливинилацетата метанолом позволяет получить поливиниловый спирт:
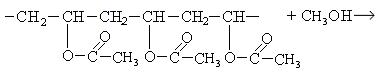
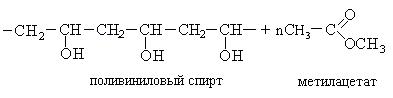
Используется поливиниловый спирт в больших количествах для повышения сохранности фруктов. Образующаяся пленка от поливинилового спирта легко растворяется в воде.
Реакции нуклеофильного присоединения (AdN):
1. Реакция со спиртами:
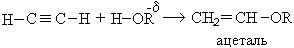
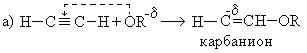
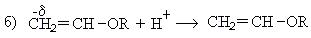
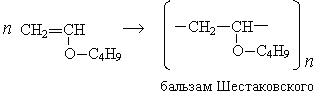
При взаимодействии ацетилена бутанолом получается винилбутиловый эфир, последующая полимеризация которого дает бальзам Шестаковского, используемый как лекарственное средство:
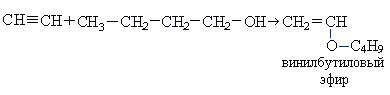
2. Взаимодействие с синильной кислотой:
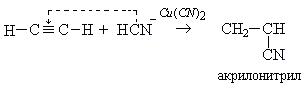
Полимеризацией акрилонитрила получают синтетическое волокно полиакрилонитрил (ПАН):
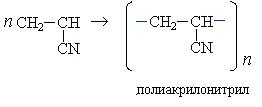
Реакции замещения (S).Атомы водорода в ацетиленовых углеводородах очень подвижны, то есть обладают определенной кислотностью и ацетилен диссоциирует по схеме:
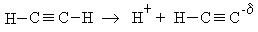
Проявление кислотных свойств ацетилена объясняется именно за счет особенностей sp-гибридизации, когда электроны π-связи сильно притягиваются ядрами атома углерода и атомы водорода практически не удерживаются ими. Кислотность ацетилена можно сравнить в следующих рядах:
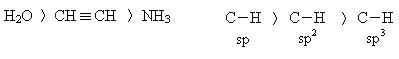
1. Взаимодействие с натрием:
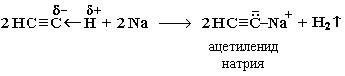
2. Взаимодействие с амидом натрия:
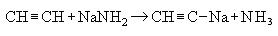
3. Взаимодействие ацетилена (или 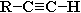 ) с аммиачными растворами оксида серебра или хлорида меди (I). При взаимодействии ацетилена с аммиачными растворами оксида серебра или хлорида меди выпадают осадки нерастворимых ацетиленидов:
) с аммиачными растворами оксида серебра или хлорида меди (I). При взаимодействии ацетилена с аммиачными растворами оксида серебра или хлорида меди выпадают осадки нерастворимых ацетиленидов:
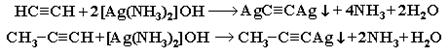
Образование белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди  ) служит качественной реакцией на концевую тройную связь.
) служит качественной реакцией на концевую тройную связь.
Ацетилениды разлагаются при действии кислот:

В сухом состоянии ацетилениды тяжелых металлов чувствительны к ударам и легко взрываются.
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:
Ацетилен: химические свойства, получение, применение, меры предосторожности
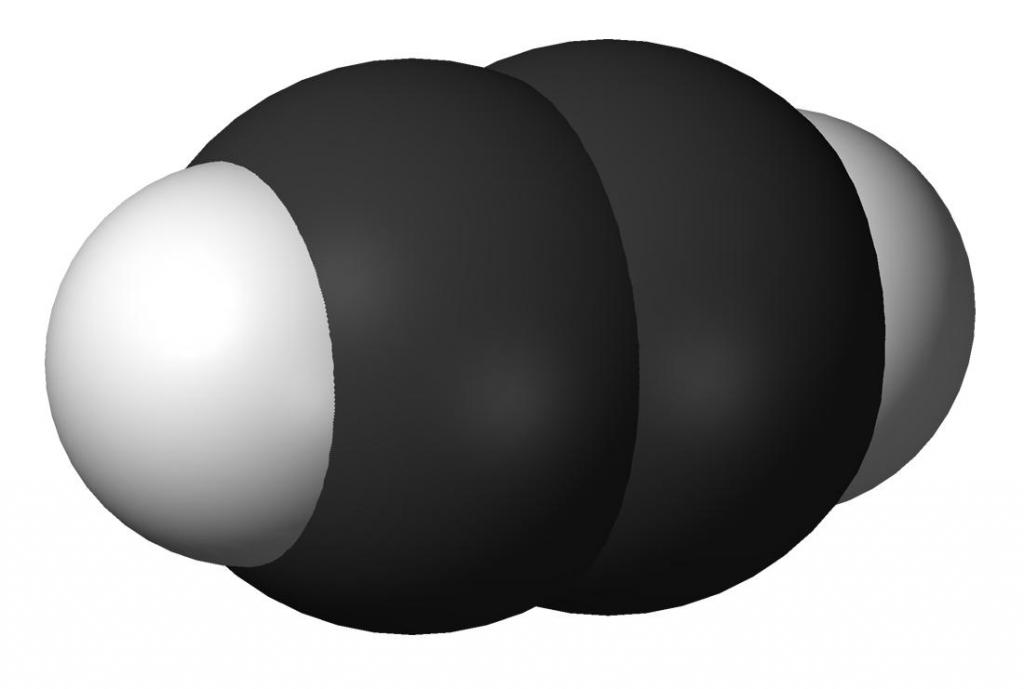
Ацетилен (или по международной номенклатуре – этин) – это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена – C2H2. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Получение
Все методы промышленного получения ацетилена сходятся к двум типам: гидролиз карбида кальция и пиролиз различных углеводородов. Последний требует меньших энергозатрат, но чистота продукта довольно низкая. У карбидного метода – наоборот.
Суть пиролиза заключается в том, что метан, этан или другой легкий углеводород при нагреве до высоких температур (от 1000 °C) превращается в ацетилен с выделением водорода. Нагрев может осуществятся электрическим разрядом, плазмой или сжиганием части сырья. Но проблема состоит в том, что в результате реакции пиролиза может образовываться не только ацетилен, но и еще множество разных продуктов, от которых необходимо впоследствии избавляться.
Карбидный метод основан на реакции взаимодействия карбида кальция с водой. Карбид кальция получают из его оксида, сплавляя с коксом в электропечах. Отсюда и такой высокий расход энергии. Зато чистота ацетилена, получаемого таким способом, крайне высока (99,9 %).
В лаборатории ацетилен также можно получить дегидрогалогенированием дигалогенпроизводных алканов с помощью спиртового раствора щелочи.
Физические свойства ацетилена
Ацетилен – это газ без цвета и запаха. Хотя примеси могут давать ему чесночный запах. Практически не растворим в воде, немного растворим в ацетоне. При температуре -83,8 °C сжижается.
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
- Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.
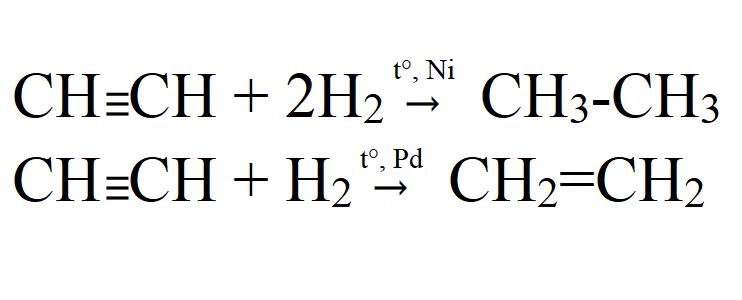
- Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.
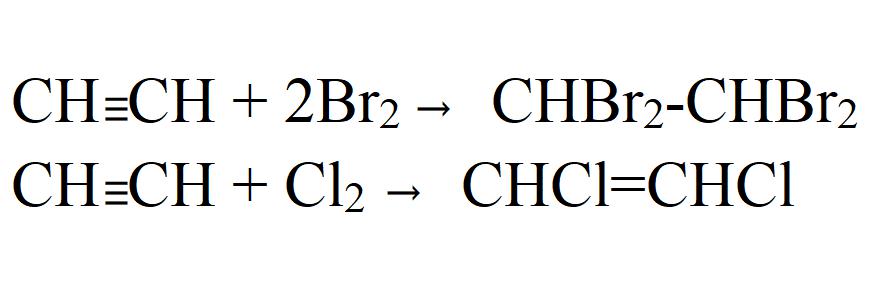
- Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.
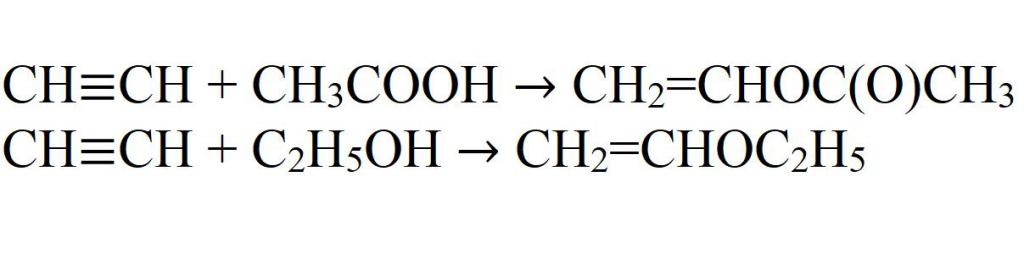
- Присоединение синильной кислоты.
- Взаимодействие ацетилена с металл-органическими соединениями.
- Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + H2
- Взаимодействие с комплексными солями меди и серебра.
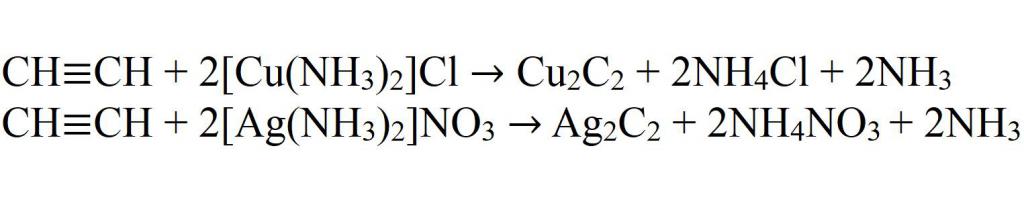
- Взаимодействие с амидом натрия.
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор – соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл – циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.
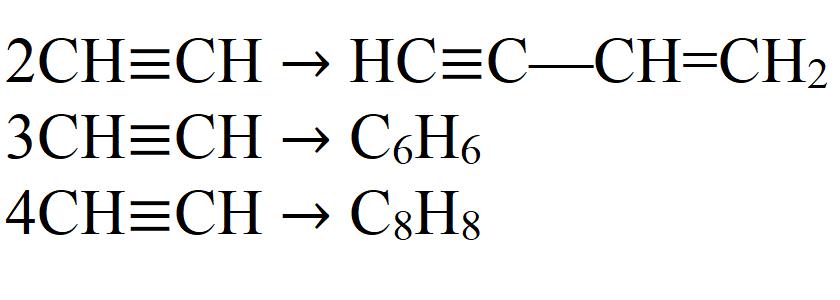
Это далеко не все химические свойства ацетилена.
Применение
Структурная формула ацетилена указывает нам на довольно прочную связь между атомами углерода. При ее разрыве, например при горении, выделяется очень много энергии. По этой причине ацетиленовое пламя обладает рекордно высокой температурой – около 4000 °C. Его используют в горелках для сварки и резки металла, а также в ракетных двигателях.
Пламя горения ацетилена имеет также очень высокую яркость, поэтому его часто используют в осветительных приборах. Используется он и во взрывотехнике. Правда, там применяется не сам ацетилен, а его соли.
Как видно из разнообразных химический свойств, ацетилен может применяться как сырье для синтеза других важных веществ: растворителей, лаков, полимеров, синтетических волокон, пластмасс, органического стекла, взрывчатых веществ и уксусной кислоты.
Безопасность
Как уже говорилось, ацетилен – огнеопасное вещество. С кислородом или воздухом он способен образовывать крайне легковоспламеняющиеся смеси. Чтобы вызвать взрыв, достаточно одной искры от статического электричества, нагрева до 500 °C или небольшого давления. При температуре 335 °C чистый ацетилен самовоспламеняется.
Из-за этого ацетилен хранят в баллонах под давлением, которые наполнены пористым веществом (пемза, активированный уголь, асбест). Таким образом, ацетилен распределяется по порам, уменьшая риск взрыва. Часто эти поры пропитывают ацетоном, из-за чего образуется раствор ацетилена. Иногда ацетилен разбавляют другими, более инертными газами (азот, метан, пропан).
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
CHEMEGE.RU
Подготовка к ЕГЭ по химии и олимпиадам
Химические свойства алкинов
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.

При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.

1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).


Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.


При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.


1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.

Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.

1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:

Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):

Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:

При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:

При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.

Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота: 
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:

Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
Взаимодействие ацетилена с водородом
Абросимова Елена Владимировна учитель химии и биологии
НАВИГАЦИЯ
Химические свойства алкинов
Физические свойства. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов (табл.6.4.1).
Таблица 6.4.1. Физические свойства алкенов и алкинов

Алкины плохо растворимы в воде, лучше – в органических растворителях.
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
Характеристики связей в алкинах:

Некоторые отличия в свойствах алкинов и алканов определяются следующими факторами.
- p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
- p-Электронное облако тройной связи сосредоточено в основном в межъядерном пространстве и в меньшей степени экранирует ядра углеродных атомов с внешней стороны. Следствием этого является доступность ядер углерода при атаке нуклеофильными реагентами и способность алкинов вступать в реакции нуклеофильного присоединения.
- Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. Это объясняется различным вкладом в гибридизованное состояние s-орбитали, которая более прочно, чем р-АО, удерживает электроны (сравните форму и энергию s- и р-АО). Доля s-АО в sp 3 -состоянии составляет 25%, в sp 2 – 33%, а в sp- 50%. Чем больше вклад s-АО, тем выше способность атома удерживать внешние электроны, т.е. его электроотрицательность. Повышенная полярность связи С(sp)-Н приводит к возможности ее гетеролитического разрыва с отщеплением протона Н + . Таким образом, алкины с концевой тройной связью (алкины-1) проявляют кислотные свойства и способны, вступая в реакции с металлами, образовывать соли.
I. Реакции присоединения к алкинам
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая
p-связь), а затем алканов (разрывается вторая p-связь):

При использовании менее активного катализатора
[Pd/CaCO3/Pb(CH3COO)2] гидрирование останавливается на стадии образования алкенов.
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая):

Алкины обесцвечивают бромную воду (качественная реакция).
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:

Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:

Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
 или в кетон (в случае других алкинов):
или в кетон (в случае других алкинов): 
1. Димеризация под действием водно-аммиачного раствора CuCl:

2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):


Возможно образование молекул, содержащих большее число звеньев ацетилена, как циклического, так и линейного строения
(такие полимеры обладают полупроводниковыми свойствами).
Следует также отметить, что высокомолекулярное вещество – карбин (третья аллотропная модификация углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl:

II. Образование солей
Ацетилен и его гомологи с концевой тройной связью  (алкины-1) вследствие полярности связи С(sp)-Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды :
(алкины-1) вследствие полярности связи С(sp)-Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды :
 Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена ( раздел 6.5 ).
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена ( раздел 6.5 ).
При взаимодействии ацетилена (или  ) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
 Образование белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди
Образование белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди  ) служит качественной реакцией на концевую тройную связь. Ацетилениды разлагаются при действии кислот:
) служит качественной реакцией на концевую тройную связь. Ацетилениды разлагаются при действии кислот:  В сухом состоянии ацетилениды тяжелых металлов чувствительны к ударам и легко взрываются.
В сухом состоянии ацетилениды тяжелых металлов чувствительны к ударам и легко взрываются.
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:

III. Окисление алкинов
Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:

Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения.
При сгорании (полном окислении) ацетилена выделяется большое количества тепла:

Температура ацетиленово-кислородного пламени достигает 2800- 3000 ° С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест или кизельгур.
Окисление ацетилена и его гомологов протекает в зависимости от того, в какой среде протекает процесс.



