Объемно центрированная кристаллическая решетка металла
Кристаллическая структура металлов
Изучение металлов в соответствии с периодической системой элементов Менделеева показывает, что за исключением Mn и Hg элементы подгруппы А, в том числе переходные металлы и большинство редкоземельных элементов, а также металлы подгрупп IB и IIB и некоторые элементы группы IIIB, в том числе Al образуют одну из следующих типичных металлических структур:
А1 – кубическая гранецентрированная решетка (ГЦК)
Кубической гранецентрированной решеткой обладают следующие металлы: g – Fe, Al, Cu, Ni, a – Co, Pb, Ag, Au, Pt и др.
В кубической гранецентрированной решетке атомы располагаются по вершинам элементарной ячейки и в центрах ее граней (рис.1.5).
Каждый атом в этой решетке окружен 12-ю ближайшими соседями, располагающихся на одинаковых расстояниях, равных = 0,707×а, где а – ребро элементарной ячейки. Число ближайших соседей, равное 12-ти называется координационным числом кристаллической решетки. Кроме этих ближайших атомов, в кристаллической решетке имеется 6 атомов, удаленных на значительно большие расстояния, равные а.
Рассматриваемая кристаллическая решетка имеет два вида пустот, (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах) образующих твердые растворы внедрения.
Наибольшие междоузлия или пустоты находятся в центре куба и посередине его ребер. Каждая из этих пустот окружена шестью атомами ГЦК решетки, занимающими места в вершинах правильного октаэдра. В связи с этим, они называются октаэдрическими пустотами (рисунок 1.5, б). Такие положения различных элементов в гранецентрированной кубической решетке занимают атомы Na и Cl в решетке NaCl. Такие же положения занимает углерод в решетке g – Fe.
Кроме этих пустот в ГЦК решетке имеются более мелкие пустоты, называемые тетраэдрическими, в связи с тем, что их окружают 4 атома. Всего в ГЦК решетке 8 тетраэдрических пустот (рисунок 1.5, в).
Размеры тетраэдрических и октаэдрических пустот можно ощутить, если предположить, что решетка построена из жестких шаров, радиусом r, соприкасающихся друг с другом; в этом случае в имеющиеся промежутки можно было бы поместить сферы, радиусом 0,41 r и 0,225 r соответственно для октаэдрической и тетраэдрической пустот.
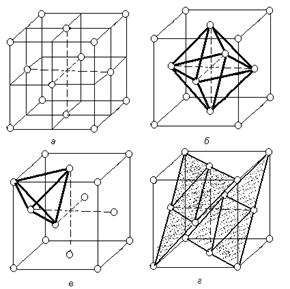
Наиболее плотноупакованными плоскостями в структуре гранецентрированного куба являются плоскости изображенные на рисунке. Их условное обозначение <111>(рисунок 1.5., г).
Объемно-центрированную кубическую решетку А2 (ОЦК) имеют металлы a – Fe, хром, вольфрам, молибден, ванадий, натрий, литий и другие. Структура А2 является менее плотноупакованной.
Атомы в решетке ОЦК располагаются в вершинах и в центре элементарной ячейки (рисунок 1.6).
Каждый атом в этой ячейке имеет 8 ближайших соседей, располагающихся на расстоянии где, а – длина ребра куба. Следовательно, координационное число решетки равно 8. Иногда его обозначают (8 + 6), т.к. следующие по удаленности атомы расположено на расстоянии а, число их равно 6.
В структуре ОЦК также имеются 2 типа пустот. Крупные занимают положения на гранях куба (рисунок 1.6, в). Они окружены 4 атомами, располагающимися в вершинах тетраэдра, ребра которых попарно равны. Более мелкие пустоты, окруженные 6 атомами, занимающими места в вершинах неправильного октаэдра, располагаются посередине ребер и граней ячейки (рисунок 1.6, г). Если структуру ОЦК решетки построить из жестких шаров, то в тетраэдрические пустоты можно поместить сферы радиусом 0,292 r, а в октаэдрические – 0,154 r.

Таким образом, максимальный размер сферы, которую можно поместить в пустоты более плотно упакованной решетки ГЦК оказывается большим, чем в решетку ОЦК.
Внедрение других атомов в октаэдрическую пору ОЦК решетки вызывает смещение двух атомов в направлении параллельными ребру куба, что вызывает расширение решетки в этом направлении. В структуре мартенсита, где атомы углерода внедряются в октаэдрические пустоты, расположенные только на ребрах, параллельных оси С и в центрах граней, перпендикулярных этой оси, это приводит к тетрагональному искажению решетки a – Fe.
Наиболее плотноупакованными плоскостями ОЦК являются 12 плоскостей семейства <110>(рисунок 1.6.б). В этих плоскостях имеются 2 направления, в которых жесткие шары могут соприкасаться.
Гексагональной плотноупакованной решеткой А3 (ГПУ) обладают такие металлы, как Zn, b – Co, Cd, Mg, a – Ti, a – Zr.
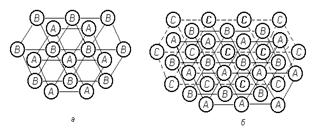
Гексагональная решета построена из отдельных слоев, причем таким образом, что каждый атом любого слоя окружен 6 расположенными на равных расстояиях соседями, принадлежащими этому же слою, и, кроме того, имеет по три ближайших соседа в слоях, расположенных выше и ниже данного слоя (рисунок 1.7).

Расстояние между атомами в гексагональных слоях обозначается через а, высота ячейки через с. Шесть ближайших соседей, расположенных в смежных слоях будут также находиться на расстоянии, а от данного атома, если отношение осей с/а составит, то такая структура называется идеальной плотноупакованной. Причем координационное число в этом случае, также как и в ГЦК решетке, равно 12.
Большинство металлов с гексагональной плотноупакованной решеткой имеет отношение осей с/а = 1,56 – 1,63. Исключения составляют Zn и Cd (1,86; 1,89). Это связано с тем, что электронные облака атомов Zn и Cd не обладают сферической симметрией и вытянуты вдоль оси С. В гексагональной плотноупакованной решетке, также как и в ГЦК, имеется 2 вида пустот: октаэдрические и тетраэдрические (рисунок 1.7, б).
Диаметры жестких сфер, которые могут быть помещены в эти пустоты также как и для ГЦК равны 0,41 r и 0,225 r.
Достаточно взглянуть на построение плотноупакованных плоскостей ГЦК решетки <111>(рисунок 1.8, а), чтобы найти полную аналогию в построении атомов в этих двух решетках. Разница этих решеток состоит в чередовании слоев. Если в гексагональной решетке происходит чередование слоев АВАВ и т.д., то в ГЦК решетке: АВСАВС (рисунок 1.8, б), т.е. при этом используется третье возможное положение плотноупакованного слоя.
Разница в энергетическом отношении между этими двумя решетками незначительна и, в связи с этим, последовательность чередования слоев может легко нарушиться при пластической деформации, а также в результате возникновения дефектов кристалла во время его роста, так называемых дефектов упаковки.
Таким образом, кажущаяся разница в построении ГПУ и ГЦК решетки совсем не велика (рисунок 1.8).
Углерод в виде алмаза, кремний, германий, a – олово (серое) имеют двойную кубическую решетку типа алмаза (рисунок 1.9). Она отличается от ГЦК решетки наличием в четырех из восьми тетраэдрических пустот дополнительно четырех атомов. В результате, структура оказывается более рыхлой.
Каждый атом алмаза окружен лишь четырьмя ближайшими соседями, располагающимися в углах правильного тетраэдра. Координационное число такой структуры равно 4.
Как было показано выше, одни и те же металлы при разных температурах могут иметь разное кристаллическое строение, что вызвано их аллотропией.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела.
В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы a – Fe с объемно-центрированной кубической решеткой в высокотемпературную форму g – Fe с гранецентрированной кубической решеткой, при температуре 910 °С и последующее превращение при температуре 1392 °С g – Fe в d – Fe с объемно-центрированной кубической решеткой, аналогичной a – Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются a – Ti, a – Zr с гексагональной плотноупакованной решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются b – Ti и b – Zr, обладающие объемно-центрированной решеткой.
Как вы видели, аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава претерпевающего аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла. Температура перехода называется критической точкой превращения. При температуре (Т) наблюдается фазовое равновесие двух аллотропических разновидностей.
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева при нагреве.
Аллотропическое превращение происходит, так же как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии.
Кубическая гранецентрированная решетка
В твердых телах встречается два варианта пространственного размещения атомов: беспорядочное (без определенного взаимного расположения) и упорядоченное (с конкретными их положениями). Первый тип называют аморфным. Он характерен для веществ с признаками твердых тел, имеющих постоянные форму и объем, но без точных температур плавления и кристаллизации. Второй вариант структуры называют кристаллическим. Условные прямые, соединяющие атомные центры, именуют кристаллической решеткой. Их дифференцируют на простые и сложные. К последним относится кубическая гранецентрированная решетка.

Структура и геометрия
Кристаллические решетки представляют совокупность кристаллитов. В ближних зернах они взаимно расположены под некоторым углом. Атомы, представляющие собой микроскопические частицы вещества и наименьшие части химических элементов, в кристаллитах размещены в соответствии с ближним и дальним порядком. Первый подразумевает определенный порядок размещения и стабильности ближайших друг к другу микрочастиц, второй – самых отдаленных. Возможно покидание отдельными атомами мест расположения вследствие диффузии, однако это не приводит к нарушению упорядоченности строения.

Тип решетки определяют формой простейшего геометрического тела, образующего ее. Кубические решетки дифференцируют на четыре вида:
- кубическая с микрочастицами в углах;
- объемно-центрированный вариант имеет восемь атомов, расположенных по углам, и один в центре;
- гранецентрированная кубическая решетка отличается размещением атомов в центрах граней и вершинах;
- гексагональная плотноупакованная с нахождением микрочастиц в углах шестигранной призмы, в центре оснований и трех в центральной плоскости.
К основным параметрам решеток относят компактность, под которой понимают степень заполнения объема атомами. Ее определяют тремя прочими показателями:
- параметр решетки – значение межатомного расстояния в нм по ребру простейшей ячейки (характеризуется для кубических вариантов длиной ребра);
- координационное число, под которым понимают количество ближайших соседних микрочастиц;
- плотность упаковки, представленная отношением общего атомного объема решетки и ее общего объема.

Для измерения параметра решеток применяют рентгеноструктурный метод анализа. При подсчете количества атомов учитывают, что каждый из них принадлежит к нескольким ячейкам сразу. Для кубических решеток исключение представляет размещенная в центре куба микрочастица.
Для объемно-центрированного типа координационное число составляет 8 по числу ближайших атомов к центральному. Для гранецентрированного варианта микрочастица на кубической грани размещена на одинаковом расстоянии от четырех в углах, четырех на гранях, четырех ближайшей кристаллической ячейки. То есть, координационное число составляет 12.
Различные варианты кристаллических решеток характеризуются разной плотностью упаковки. Для простой кубической решетки координационное число равно 6, для ОЦК — 8, ГЦК и ГП (гексагональной плотноупакованной) — 12.
Для объемно-центрированного варианта объемы микрочастиц и межатомных промежутков соотносятся в пропорции 68/32%, для ГЦК значения соответствующих параметров равны 74 и 26% соответственно. Компактность решетки определяется особенностями металлической электронной структуры и характером атомной связи.
Ввиду упорядоченности решетки возможно выделение кристаллографических плоскостей и направлений.
Под направлениями понимают прямые, вдоль которых находятся атомы. То есть они представлены ребрами, диагоналями и гранями.
Плоскости подразделяют на диагональные и плоскости кубических граней.
Для обозначения данных категорий применяют трехзначные индексы. Для направлений их определяют путем нахождения ближайшего атома и использования его координат относительно точки O. Для плоскостей находят координаты точек их пересечения с осями координат и меняют на обратные.
Следует отметить, что в кристаллических телах наблюдается изменение механических свойств вдоль направлений. Данная особенность, называемая анизотропией, объясняется различной атомной плотностью. Так, для кубических решеток вдоль диагоналей и на диагональных плоскостях данный показатель больше, чем вдоль ребер и на проходящих сквозь грани плоскостях. При этом анизотропия наблюдается в пределах кристаллита либо монокристалла. Для поликристаллических тел она нехарактерна ввиду усреднения параметров по всем направлениям для большого числа произвольно взаимно ориентированных зерен. Ввиду этого металлы относят к псевдо- или квазиизотропным телам.
Кроме того, для некоторых металлов (Ti, Fe, Sn) характерна аллотропия, под которой понимают изменение кристаллического строения путем изменения типа простейшей ячейки. Также данное свойство называют полиморфизмом.
Так, у железа в температурном интервале 911-1392 °C кубическая решетка гранецентрированного типа, а при температурах за пределами приведенного диапазона – отдельно-центрированная (до плавления при 1539 °C). Для дифференциации аллотропических форм применяют греческие буквы.
Возможно наличие дефектов решетки. Их классифицируют на несколько типов.
- Точечные, по размеру близкие к атомам, представлены вакансиями (пустые узлы, межузельные микрочастицы), примесными атомами замещения (того же размера, что и исходные) и внедрения (маленькие микрочастицы в междоузлиях).
- Линейные (протяженные) представлены дислокациями (плоскостные смещения). Их классифицируют на наиболее распространенные краевые (экстраплоскость или полуплоскость) и винтовые (закручивание плоскостей).
- Поверхностные – искажения на границах зерен ввиду передвигающихся зерен дислокации.
- Объемные – поры и трещины.

Названные дефекты по-разному сказываются на прочности. Для точечных степень влияния на данный показатель определяется их характером и числом в конкретном объеме. Линейные дефекты ввиду большой подвижности значительно сказываются на прочности, упрощая сдвиги кристаллитов под влиянием напряжений. Воздействие линейных дефектов на прочность оценивают по их плотности (отношение их общей длины к объему материала). Ее предельное значение – 10 13 см -2 (при большем происходит разрушение). На основе того, что мелкозернистые материалы более прочны в сравнении с крупнозернистыми при большей общей протяженности границ, поверхностные дефекты наоборот повышают прочность. Объемные, помимо непосредственного снижения прочности, значительно повышают напряжения от рабочих нагрузок, концентрируя их.
Примеры материалов
Все металлы характеризуются кристаллическим строением. Они отличаются наличием малоподвижных ионов с положительным зарядом и движущимися между ними электронами. Данные структуры именуют металлическими связями.
Объемно-центрированная кубическая решетка свойственна для Fe при комнатной температуре, W, V, Cr, Mo и прочих металлов.

Гранецентрированная кубическая решетка встречается на Mg, Ti, Zn, Zr и прочих металлах.
мтомд.инфо
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место. Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике. Причина этого — в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
- «металлический блеск» (хорошая отражательная способность);
- пластичность;
- высокая теплопроводность;
- высокая электропроводность.
Строение металлов. Атомно-кристаллическое строение металлов.
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Кристаллическая решетка металлов
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка. Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов (в одном направлении выдерживаются строго определенными);
- углы между осями (α, β, χ);
- координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке;
- базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки;
- плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74).
Схема кристаллической решетки

Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа:
- примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
- базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
- объемно-центрированный – атомы занимают вершины ячеек и ее центр;
- гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней.
Типы кристаллических решеток

Рис. 2: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Основными типами кристаллических решеток являются:
- Объемно — центрированная кубическая (ОЦК) (рисунок 2, позиция а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
- Гранецентрированная кубическая (ГЦК) (рисунок 2, позиция б), атомы рассполагаются в вершинах куба и по центру куждой из 6 граней (Ag, Au, Feγ)
- Гексагональная, в основании которой лежит шестиугольник:
- – простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
- – плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Кристаллические решетки металлов и их основные типы
Металлы и сплавы имеют кристаллическое строение. Это означает, что атомы в занимаемом ими пространстве расположены строго упорядоченно, находясь в определенных местах на вполне определенных расстояниях друг от друга. В пределах одного кристалла наблюдается повторяющаяся картина расположения атомов. Если соединить атомы воображаемыми линиями в трех взаимно перпендикулярных направлениях, то получится пространственная
кристаллическая решетка. Ее наименьшим структурным образованием является элементарная ячейка, контур которой представляет какое-нибудь составленное из атомов геометрическое тело, например куб или шестигранную призму. Элементарные ячейки, примыкая друг к другу и многократно повторяясь, образуют более крупные твердые тела правильной геометрической формы — кристаллы. Кристаллы, формирующиеся в процессе роста под воздействием окружающих кристаллов и имеющие поэтому неправильную геометрическую форму, называют кристаллитами. Кристаллиты в поликристаллическом теле, отделенные от других кристаллитов большеугловыми границами (см. подпараграф 1.5.3) и обладающие определенной кристаллографической ориентировкой, называют зернами.
Ориентировка ячеек в соседних зернах различна, а в пределах каждого зерна одинакова. Поэтому в кристаллической решетке зерен существует ближний и дальний порядки. Ближний порядок означает постоянство ближних атомов-соседей у каждого атома, а дальний — удаленных.
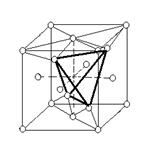
Наиболее простой геометрической формой кристаллической решетки металлов является кубическая. Эта форма решетки имеет две разновидности: объемно-центрированную кубическую (ОЦК) и гранецентрированную кубическую (ГЦК). На рис. 1.3, а, б показаны схемы этих решеток. У обоих типов рассматриваемых решеток основу ячеек составляют восемь атомов, образующих куб и находящихся в его вершинах. Остальные атомы находятся или в центре куба (один атом на пересечении диагоналей в решетке ОЦК), или в центре каждой из его граней (шесть атомов в решетке ГЦК).
Кристаллические ОЦК-решетки в числе прочих металлов имеют хром, ванадий, молибден. А ГЦК-рсшстки имеют алюминий, медь, никель и другие металлы. Характерными признаками кристаллической решетки являются параметр решетки, координационное число и плотность упаковки атомов. Параметром (или периодом) кристаллической решетки а считают межатомное расстояние в ячейке (см. рис. 1.3). Координационное число (к.ч.) определяет

Рис. 1.3. Основные тины кристаллических решеток
число ближайших соседей каждого атома. А под плотностью упаковки (п.у.) понимают число атомов, приходящихся на одну элементарную ячейку. Для решетки ОЦК п.у. = 2 (один атом в вершине куба, а второй в центре куба), к.ч. = 8 (например, для атома, расположенного в центре куба). Для решетки ГЦК п.у. = 4, к.ч. = 12. Параметр решетки а для ОЦК-решеток и ГЦК-решеток одинаков по всем трем направлениям в пространстве.
Таким образом, ГЦК-решетка является более плотной, чем ОЦК-решетка. От плотности упаковки кристаллической решетки зависит прочность металлов.
Однако наиболее плотной из рассматриваемых кристаллических решеток является гексагональная плотноупакованнаярешетка (ГПУ). Схема этой решетки представлена на рис. 1.3, в. Ячейка этой решетки представляет собой шестигранную призму с центрированными основаниями, между которыми на некотором расстоянии от центров трех граней расположены еще три атома. Характеристики решетки ГПУ: параметры решетки а и с (с > а); если с/а = 1,633, то к.ч. = 12, п.у. = 6. Решетку ГПУ имеют магний, цинк, бериллий и другие металлы.
Параметры кристаллических решеток металлов составляют от 0,2 до 0,7 нм (1 нм = 1(Г 9 м).
В ячейках кристаллических решеток атомы касаются друг друга внешними слоями электронных оболочек. Межатомные силы сцепления, обеспечивающие целостность кристаллической решетки, создаются электромагнитным взаимодействием, обусловленным наличием у атомов валентных электронов. У металлов, находящихся в твердом состоянии, валентные электроны, освобождаясь от своих атомов, движутся между атомами, которые становятся положительно заряженными ионами. Это объясняется тем, что внешние электроны металлов, в отличие от внешних электронов неметаллов, слабо связаны с ядром. Поэтому атомы металлов легко теряют внешние электроны, превращаясь в ионы. Освободившиеся электроны образуют так называемый электронный газ. Принадлежащие всему зерну свободные электроны, взаимодействуя с положительными ионами, обеспечивают целостность кристаллической решетки. Такая межатомная связь в кристаллической решетке получила название металлической. Металлическая связь может существовать как между одноименными атомами в чистых металлах, так и между разнородными — в сплавах. Металлическая межатомная связь не имеет направленного характера. Электроны электронного газа не связаны с отдельными ионами, а в одинаковой степени принадлежат всем ионам металла.
Благодаря наличию электронного газа металлы обладают высокими электро- и теплопроводностью, а также металлическим блеском. Под действием электрического поля свободные электроны
приобретают направленное движение, обеспечивающее протекание тока. Высокая теплопроводность металла обусловлена также участием свободных электронов (наряду с ионами) в передаче тепла. А характерный металлический блеск металлов обусловлен взаимодействием свободных электронов с электромагнитными световыми волнами.



